膵臓がんに対する新たな抗がん剤オニバイド(ナノリポソーム型イリノテカン)
日本セルヴィエは、2020年6月1日に「がん化学療法後に増悪した治療切除不能の膵癌」に対して、抗悪性腫瘍剤抗イリノテカン塩酸塩水和物 リポソーム製剤(商品名 オニバイド点滴静注43mg)を発売しました。
膵臓がんに対する新しい抗がん剤として久しぶりに登場したこの「オニバイド」に期待が集まっています。
切除不能(転移性)膵臓がんに対する1次治療としては、FOLFIRINOX(フォルフィリノックス)やゲムシタビン+ナブパクリタキセル併用療法などが選択されます。
一方で、1次治療増悪例における2次治療に関しては、まだ効果がしっかりと確認された推奨レジメン(薬剤)はありません。
今回のオニバイドに5-FU/ロイコボリンを併用した治療は、ゲムシタビンをベースとした1次治療によって増悪した切除不能膵臓がんに対する2次治療として期待されています。ガイドライン(膵癌診療ガイドライン2019年版改定)上も、2次治療としての選択肢のひとつに追加されています。
今回は、このオニバイドについて、臨床試験の結果についての報告をまとめて紹介します。
オニバイドとは?
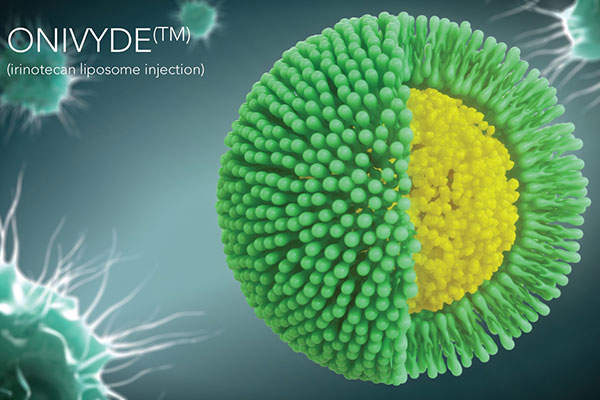
オニバイド(ONYVIDE)は、既存の抗がん剤であるイリノテカン(商品名 カンプト、トポテシン)をポリエチレングリコール(PEG)で修飾したリポソームに封入した製剤です。

イリノテカンは、すでに様々ながんに対して使われている抗がん剤で、トポイソメラーゼ阻害作用によって細胞のDNA合成を阻害することにより増殖抑制作用を示す薬剤です。
このイリノテカンをリポソーム化することによって、より薬剤が腫瘍へ届きやすい仕組み(ドラッグデリバリーシステム:DDS)となっています。
次に、膵臓がん患者を対象とした、オニバイドの有効性と安全性を調査した臨床試験を紹介します。
オニバイドの第三相臨床試験(NAPOLI-1試験)

ゲムシタビンをベースとする化学療法後に増悪した、遠隔転移を有する膵臓がん患者を対象とした海外第3相試験(NAPOLI-1試験)が実施され、オニバイドの有効性と安全性が確認されました。
Nanoliposomal irinotecan with fluorouracil and folinic acid in metastatic pancreatic cancer after previous gemcitabine-based therapy (NAPOLI-1): a global, randomised, open-label, phase 3 trial.
Lancet. 2016 Feb 6;387(10018):545-557. doi: 10.1016/S0140-6736(15)00986-1. Epub 2015 Nov 29.
対象と方法
NAPOLI-1試験は、14の国(76施設)にわたって行われた国際的な無作為化オープンラベル第三相臨床試験です。
対象は、過去にゲムシタビンを含む治療を受けた後に増悪した転移性膵臓がん患者417人です。
これらの患者を、オニバイド+5-FU/ロイコボリン併用(117人)、オニバイド単独(151人)、または5-FU/ロイコボリン(149人)の3つのグループにランダムに割り付けました。
結果
■ 生存期間の中央値は、オニバイド+5-FU/ロイコボリン併用群が6.1ヶ月(95% CI 4.8–8.9ヶ月)であり、5-FU/ロイコボリン群の4.2ヶ月(95% CI 3.3–5.3)に比較して有意に死亡リスクを低下させるという結果でした(ハザード比 0.67、p = 0·012)。
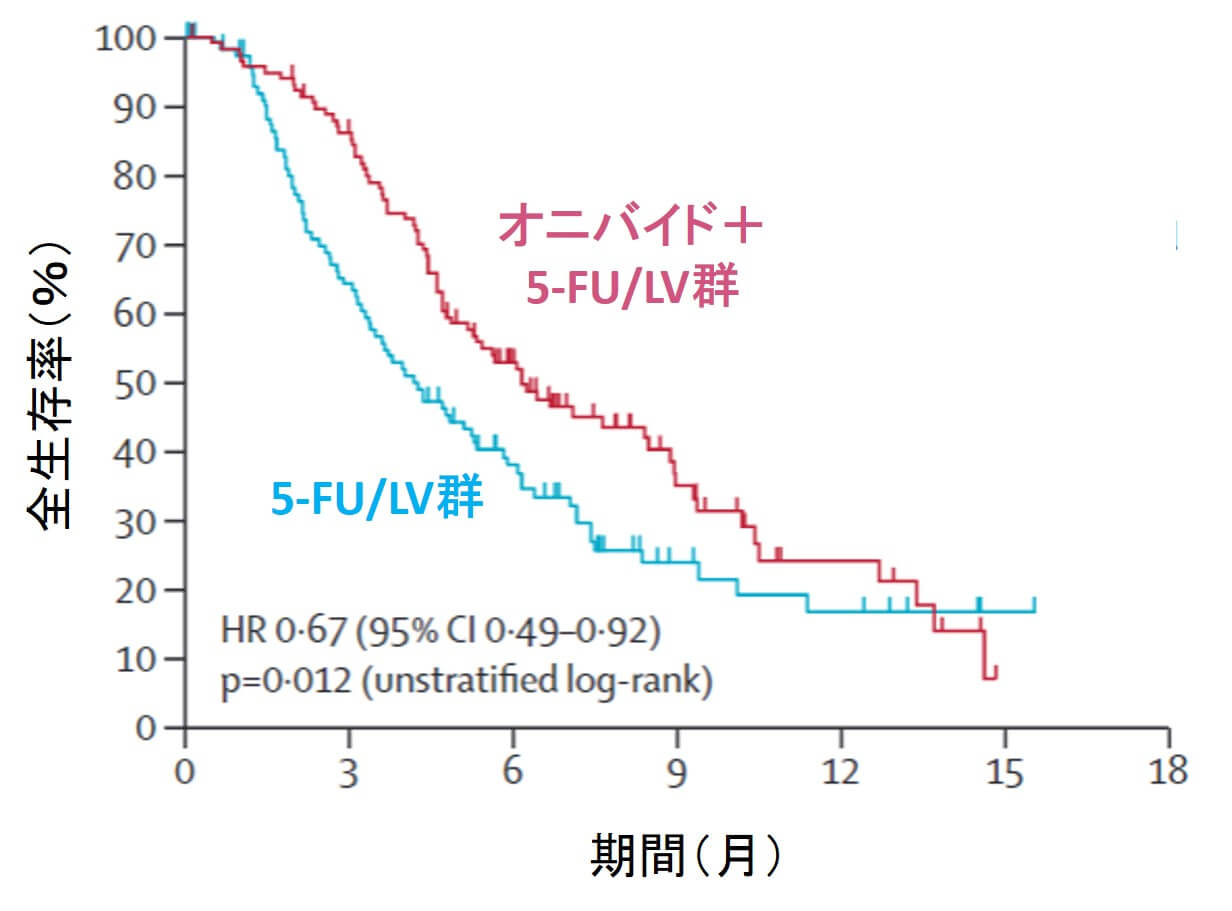
■ 一方で、オニバイド単独群(生存期間4.9ヶ月)と5-FU/ロイコボリン群(4.2ヶ月)との間に差はみられませんでした。
■ オニバイド+5-FU/ロイコボリン併用群にみられた全ての程度の副作用は、下痢(59%)、嘔吐(52%)、悪心(51%)、食欲低下(44%)、倦怠感(40%)など、消化器症状が多くなっていました。
このうち、重症(グレード3以上)の副作用は、好中球減少(27%)、下痢(13%)、嘔吐(11%)、倦怠感(14%)などでした。
その後に報告された最終的な生存率解析(Eur J Cancer. 2019)においても、生存期間の中央値がオニバイド+5-FU/ロイコボリン併用群が6.2ヶ月であり、5-FU/ロイコボリン群の4.2ヶ月に比較しておよそ25%死亡リスクを低下させるという結果でした(ハザード比 0.75)。
また、1年生存率(推定)に関しては、5-FU/ロイコボリン群が16%であったのに対して、オニバイド+5-FU/ロイコボリン併用群は26%でした。
以上の結果より、オニバイドを5-FU/ロイコボリンに併用することにより、生存期間をおよそ2ヶ月間延長する効果が認められました。
アジア人におけるオニバイドの効果
抗がん剤の効果は、人種によって異なることがあります。
今回のNAPOLI-1試験のサブグループ解析として、アジア人(台湾および韓国)の患者についての治療成績が報告されています。
Liposomal irinotecan in metastatic pancreatic adenocarcinoma in Asian patients: Subgroup analysis of the NAPOLI-1 study.
Cancer Sci. 2020 Feb;111(2):513-527. doi: 10.1111/cas.14264. Epub 2019 Dec 20.
この解析によると、アジア人患者における生存期間の中央値がオニバイド+5-FU/ロイコボリン併用群(34人)が8.9ヶ月であり、5-FU/ロイコボリン群(35人)の3.7ヶ月(に比較しておよそ50%死亡リスクを低下させるという結果でした(ハザード比 0.51)。

症例数が少ないため、今後のより大規模での臨床研究が必要ではありますが、オニバイドはアジア人でより有効である可能性があると考えられます。
オニバイドによる長期生存例の特徴
NAPOLI-1試験の最終報告(Eur J Cancer. 2019 Feb;108:78-87. doi: 10.1016/j.ejca.2018.12.007.)では、オニバイド+5-FU/ロイコボリン併用群のうち、1年以上生存した人(長期生存例)の臨床的特徴を解析しています。
その結果、長期生存例に特徴的な所見は、
- カルノフスキー パフォーマンス ステータスが90以上(全身状態が良好)
- 年齢が65歳以下
- CA19-9値が低い
- 好中球・リンパ球比(NLR)が5以下
- 肝転移がない
でした。
つまり、こういった患者さんは、オニバイドの効果が認められる可能性が高いということです。
転移性膵臓がんに対する2次治療としてのオニバイド
では、実際にはどういった患者さんにオニバイドが使われることになるのでしょうか?
現時点では、切除不能膵臓がんに対する2次治療としての位置づけです。
つまり、ゲムシタビンを含む1次治療(たとえば、ゲムシタビン単独療法やゲムシタビン+ナブパクリタキセル(アブラキサン)併用療法など)によって増悪した患者さんに対する次の治療として、オニバイド+5-FU/ロイコボリン併用が適応になると考えられます。
したがって、初回にFOLFIRINOX(フォルフィリノックス)を受けた患者さんでは、オニバイドは使えなくなります。
また、1次治療によって全身状態が悪化した患者さんでは、やはりオニバイドによる治療は難しくなってくると思います。
オニバイドによる長期生存の因子として年齢が65歳以下であることが認められていることより、高齢の患者さんには効果が期待できない可能性もあります。
とはいえ、まだまだ実臨床での効果は未知数です。
今後の臨床試験の結果や、日本人における効果や副作用などの情報によっては、使用方法や適応基準が変わることが予想されます。
まとめ
オニバイドは既存の抗がん剤であるイリノテカン(商品名 カンプト、トポテシン)をポリエチレングリコール(PEG)で修飾したリポソームに封入した製剤です。
ゲムシタビンを含む抗がん剤治療で増悪した転移性膵臓がん患者を対象とした海外の第三相臨床試験では、オニバイドを5-FU/ロイコボリンに併用することにより、生存期間をおよそ2ヶ月間延長する効果が認められました。
アジア人患者では、オニバイド+5-FU/ロイコボリン併用群の生存期間の中央値は8.9ヶ月と比較的良好でした。
現時点では、ゲムシタビンを含む1次治療によって増悪した切除不能進行膵臓がんに対する2次治療として(全身状態が保たれている患者さんに)使用されることになります。