膵臓がんに対する腫瘍溶解性ウイルスHF10の安全性と有効性:国内第Ⅰ相試験の結果

日本国内における膵癌(膵臓がん)による死亡者数は増加の一途をたどっており、現在がん死亡者数の第4位となっています。
膵臓がんが予後不良である原因には、診断時におよそ80%は切除ができないほど進行していることがあります。
この切除不能の膵臓がんに対しては、おもに抗がん剤治療が行われていますが、いまだ十分な治療成績は得られていません。
今回、局所進行膵臓がんに対して、腫瘍溶解性ウイルスHF10を腫瘍内に直接投与するという新たな治療法の試みが報告されました。
国内第Ⅰ相試験の結果では、安全性および有効性について期待が持てる結果であるとしています。
腫瘍溶解性ウイルスとは?
腫瘍溶解性ウイルス(Oncolytic virus)とは、正常な細胞内では増殖せず、感染したがん細胞内だけで特異的に増殖し、細胞を破壊するウイルスのことです。
破壊のさいに放出されたウイルスは周囲のがん細胞に感染することで、治療の効果が高まることが期待されます。
さらに、破壊されたがん細胞の断片を抗原提示細胞(マクロファージや樹状細胞)が認識し、がんに対する免疫が活性化されるという利点もあります。
腫瘍溶解性ウイルスの特徴をまとめます。
■ 正常細胞内では増殖しない
■ がん細胞内だけで増殖し、破壊する
■ 破壊されたがん細胞から放出されたウイルスが、周囲のがん細胞に感染する
■ 腫瘍免疫(がんに対する免疫反応)を活性化する
現在、アデノウイルス、ワクシニアウイルス、レオウイルス、単純ヘルペスウイルスなど、さまざまなウイルスから腫瘍溶解性ウイルスが開発されています。
このうち、アデノウイルスから作成された腫瘍溶解ウイルス製剤テロメライシン(R)と免疫チェックポイント阻害剤(抗PD-1抗体薬ペムブロリズマブ)との併用療法についての医師主導治験が開始されています(詳しくはこちらをどうぞ)。
腫瘍溶解性ウイルスHF10
HF10は単純ヘルペスウイルス1型(HSV-1)の自然変異弱毒株であり、著明な抗がん作用を発揮する腫瘍溶解性ウイルス(タカラバイオ株式会社が開発)です。
HF10は、試験管および動物実験において、単独あるいは他の抗がん剤との併用で、さまざまながんに対する治療効果が証明されています。
動物を用いた前臨床試験では、腫瘍へ直接HF10を投与することによって腫瘍が著しく縮小し、同時に活性化されたTリンパ球やナチュラルキラー(NK)細胞が腫瘍内に増えることが確認されています。
国内においては、まだ初期の段階(第Ⅰ相)ですが、頭頸部がん、(再発性)乳がん、切除不能の膵臓がんに対する医師主導臨床試験が行われています。
また米国では、難治性の表層性固形がんおよび皮膚がん(メラノーマ)に対する臨床試験が行われています。
今回、膵臓がんに対するHF10の腫瘍内投与と抗がん剤併用の第Ⅰ相臨床試験の結果が報告されました。
切除不能局所進行膵がんに対する超音波内視鏡ガイド下によるHF10腫瘍内投与と抗がん剤併用療法:第Ⅰ相試験
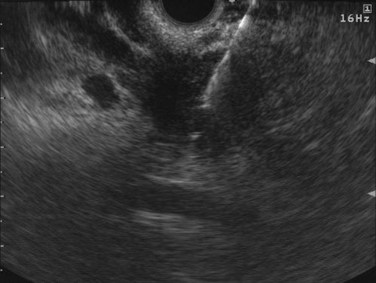
【対象と方法】
この医師主導第Ⅰ相臨床試験では、切除不能局所進行膵臓がんを対象としました。
治療として、ゲムシタビン(ジェムザール)とエルロチニブ(タルセバ)の併用療法3サイクルの途中に、超音波内視鏡(EUS)ガイド下に、腫瘍内に直接HF10(治験製品TBI-1401)を投与しました(2週間毎に合計4回)。
12人の膵臓がん患者が登録され、実際には10人(いずれもステージIII)が治療を受けました。
有害事象(副作用)および治療効果(腫瘍の縮小)について調査しました。
【結果】
【結論】
まだ第Ⅰ相試験の結果ですが、大変有望であると考えられます。
近い将来、切除不能膵癌に対して、HF10とゲムシタビン+ナブパクリタキセル(アブラキサン)の併用療法の臨床試験が計画中であるとのことです。
この新しい治療アプローチの有効性と安全性が確立され、早期に臨床へ導入されるよう期待したいですね。
応援よろしくおねがいします
いつも応援ありがとうございます。 更新のはげみになりますので、「読んでよかった」と思われたら クリックをお願いします_(._.)_!
↓ ↓ ↓ ↓ ↓ ↓



“膵臓がんに対する腫瘍溶解性ウイルスHF10の安全性と有効性:国内第Ⅰ相試験の結果” に対して1件のコメントがあります。